2021年1月19日,国家药监局关于发布免于进行临床试验医疗器械目录(第二批修订)的通告(2021年 第3号),其中包括了“3D打印截骨导板”、“牙科增材制造用金属材料”等3D打印相关医疗产品,可以免于进行临床试验,是个重磅利好消息。
2018年9月,国家药品监督管理局印发《关于公布新修订免于进行临床试验医疗器械目录的通告》(2018年第94号),对前期已发布的免于进行临床试验的医疗器械(及体外诊断试剂)目录进行了全面修订和汇总,分别印发了修订汇总后的《免于进行临床试验的医疗器械目录》和《免于进行临床试验的体外诊断试剂目录》。在此基础上,2019年12月,国家药品监督管理局印发《关于公布新增和修订的免于进行临床试验医疗器械目录的通告》(2019年第91号),公布了第一批新增和修订的免于进行临床试验的医疗器械(及体外诊断试剂)目录。
为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》和国务院深化“放管服”改革有关要求,进一步做好医疗器械注册管理工作,根据《医疗器械监督管理条例》《医疗器械注册管理办法》《体外诊断试剂注册管理办法》,国家药品监督管理局组织新增和修订了第二批免于进行临床试验医疗器械(及体外诊断试剂)目录。现予以公布,自公布之日起施行。
国家药监局
2021年1月14日
在“免于进行临床试验医疗器械目录(第二批修订)”表格中
3D打印截骨导板
△分类编号为04-16-03的 3D打印截骨导板 ,在管理类别中属于第Ⅱ类
3D打印截骨导板:骨科手术配套工具,用于匹配患者解剖结构。采用高分子聚酰胺材料或金属材料,经3D打印制成。非无菌提供,经灭菌后一次性使用。预期用于特定病人的骨科手术中定位、导向和保护。
△3D打印截骨导板
牙科增材制造用金属材料
△分类编号为17-06-00的牙科增材制造用金属材料,在管理类别中属于第Ⅲ类
牙科增材制造用金属材料:牙科增材制造用纯钛、钛合金、钴铬合金金属材料,用于通过激光选区熔化工艺加工制作牙冠、牙桥等非植入修复体,产品本体材料及性能指标须至少满足YY∕T 1702-2020 《牙科学 增材制造 口腔固定和活动修复用激光选区熔化金属材料》、GB 17168 《牙科学 固定和活动修复用金属材料》等相关国家和行业标准要求。豁免情况不包括用于制作颌面赝复体、种植体、基台及附件的产品及与已上市产品相比采用新材料、新技术或具有新作用机理、新功能的产品。
△使用钴铬合金3D打印的牙冠。齿科金属3D打印工艺,已经开始变革传统的义齿制造工艺。中国的金属3D打印机市场,齿科专用金属3D打印机2019年、2020年出货量均超过200台,从数量上占据半壁以上的江山
不包括3D打印等创新工艺的产品
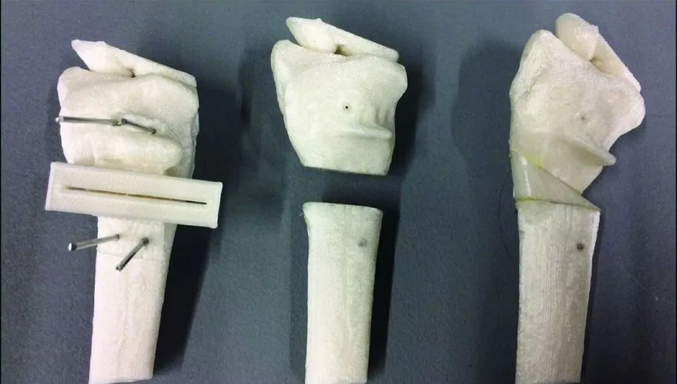
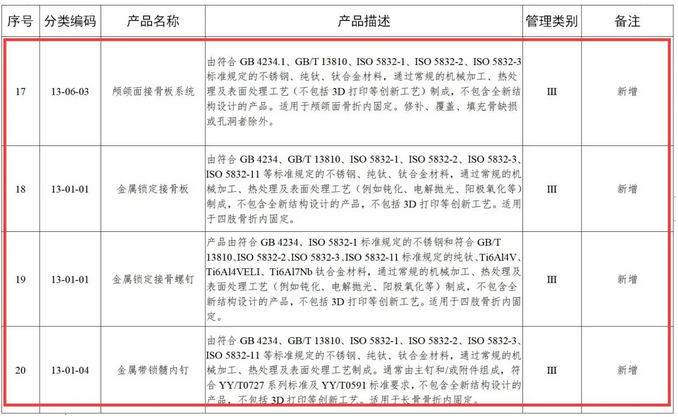
但是,同样在此表中,颅颌面接骨板系统、金属锁定接骨板、金属锁定接骨螺钉、金属带锁髓内钉等明确指出,不包括3D打印等创新工艺。也就是说,这四种产品,如果是使用3D打印来制造的,不属于本次“免于进行临床试验医疗器械”
△不包括3D打印等创新工艺的医疗产品
来源:3D打印医疗器械专业委员会 | 



















你可能喜欢
开源3D建模软件FreeCAD 1.0正式发布,支持W
eSUN易生携趣味美学材料PLA光变线材等新品
强势吸睛!三绿亮相Formnext 2024,发布工
Formnext 2024:中体新材将与APWORKS深化合
推荐课程
神奇的3D打印
SLA3D打印工艺全套培训课程 - 软件篇
3D打印月球灯视频教程 包括完整贴图建模流
【原创发布】Cura软件修改二次开发定制视频